Avances en Retardar la Progresión de la T1D
La diabetes tipo 1 (T1D) se está abordando cada vez más como una condición que requiere intervención temprana para ralentizar su progresión, con numerosos agentes en investigación. El primer fármaco modificador de la enfermedad, el anticuerpo monoclonal anti-CD3 sin unión al receptor Fc, teplizumab, fue aprobado por la Administración de Alimentos y Medicamentos de EE. UU. (FDA) en 2022. Teplizumab está indicado para retrasar la aparición de la T1D clínica en pacientes de 8 años o más con T1D en etapa 2 y se administra en un régimen ambulatorio de 14 días por vía intravenosa, con dosis ajustadas a la superficie corporal.¹
La aprobación de teplizumab por la FDA se basó en el ensayo clínico de fase 2 AT-Risk (TN-10), un estudio doble ciego realizado en familiares de personas con T1D con alto riesgo de desarrollar la enfermedad clínica. En este estudio, los participantes recibieron un tratamiento de 14 días con teplizumab o placebo y fueron monitoreados cada 4 meses mediante una prueba de tolerancia oral a la glucosa. A los 6 años de seguimiento, el 50% de los pacientes que recibieron teplizumab permanecían libres de diabetes en comparación con solo el 22% del grupo placebo (ver figura a continuación). Los efectos adversos más comunes fueron erupción cutánea y linfopenia transitoria.² ³
El tratamiento con teplizumab logró retrasar la progresión a la etapa 3 de la T1D en un promedio de 32.5 meses adicionales en comparación con el placebo. El tiempo medio hasta el diagnóstico fue de 59.6 meses en el grupo tratado con teplizumab frente a 27.1 meses en el grupo placebo, con algunos individuos experimentando retrasos aún mayores. Además, el tratamiento con teplizumab mostró una reversión en la disminución del péptido C y una mejora en la función de las células beta en comparación con el placebo.³
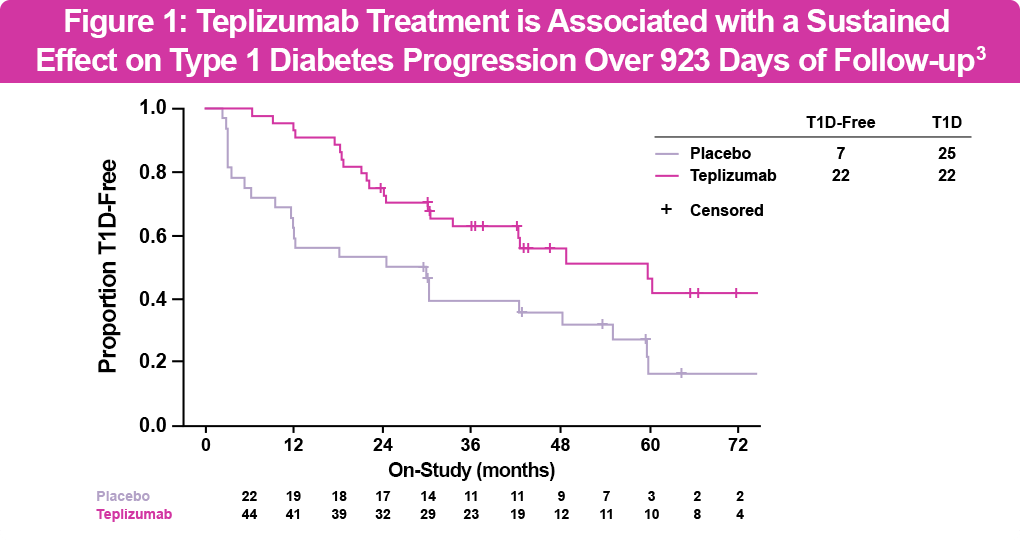
Curva de Kaplan-Meier actualizada
Basada en 923 días de seguimiento (rango 74–3119 días). La razón de riesgo (hazard ratio) para el desarrollo de diabetes tipo 1 en los participantes tratados con teplizumab frente a placebo fue de 0.457; P = .01. El tiempo medio hasta el diagnóstico de diabetes fue de 27.1 meses en el grupo placebo y de 59.6 meses en el grupo tratado con teplizumab. Al final de este período, 7 (22%) pacientes y 22 (50%) pacientes, respectivamente, no habían sido diagnosticados con T1D.
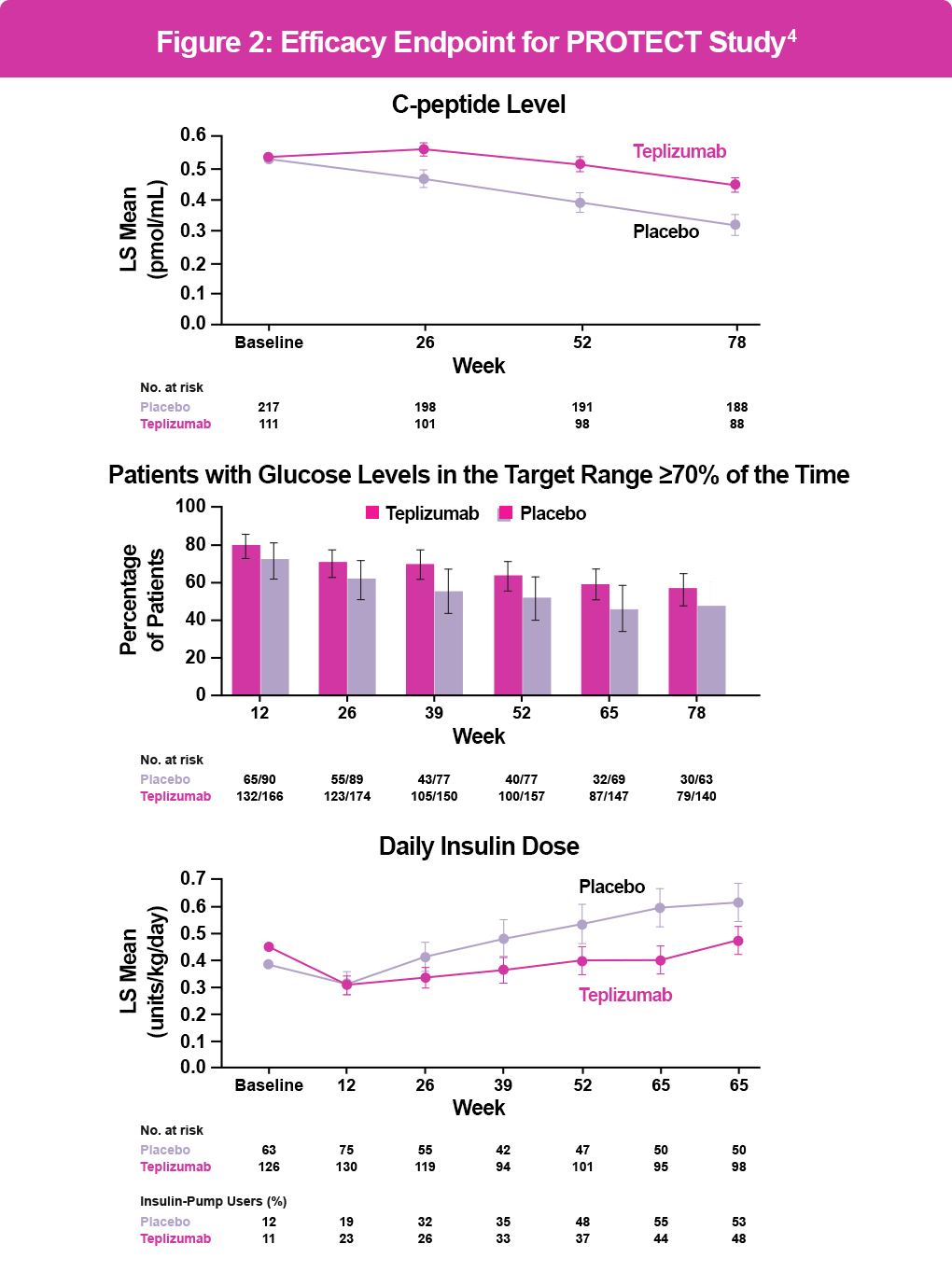
Además, los resultados del estudio de fase 3 PROTECT, publicados en el New England Journal of Medicine a finales de 2023, demostraron la posible utilidad de teplizumab en pacientes con diagnóstico reciente de T1D.⁴
El ensayo PROTECT incluyó a 328 niños y adolescentes con T1D en etapa 3 que habían sido diagnosticados dentro de las 6 semanas previas a la aleatorización, asignándolos a recibir teplizumab o placebo en dos cursos de 12 días. El criterio de valoración principal fue la preservación de las células β, medida por los niveles de péptido C estimulado en la Semana 78. Los criterios de valoración secundarios clave incluyeron las dosis de insulina necesarias para alcanzar los objetivos glucémicos, los niveles de hemoglobina glicosilada (HbA1C), el tiempo dentro del rango de glucosa objetivo y los eventos hipoglucémicos clínicamente significativos.⁴
Los pacientes tratados con teplizumab (n=217) mostraron niveles significativamente más altos de péptido C estimulado que aquellos que recibieron placebo (n=111) en la Semana 78 (intervalo de confianza [IC] del 95%: 0.09–0.17; P < .001); el 94.9% de los pacientes tratados con teplizumab mantuvieron un nivel máximo de péptido C clínicamente significativo de ≥0.2 mmol/mL (IC del 95%: 89.5–97.6) en comparación con el 79.2% de los que recibieron placebo (IC del 95%: 67.7–87.4) (ver figura a continuación). Los grupos no mostraron diferencias significativas en los criterios de valoración secundarios clave. Los efectos adversos ocurrieron principalmente durante la administración del fármaco o placebo e incluyeron cefalea, síntomas gastrointestinales, erupción cutánea, linfopenia y síndrome de liberación de citocinas (CRS) leve.⁴
Consideraciones para el Uso de Teplizumab y Selección de Pacientes
Si se confirma que una persona tiene T1D en etapa 2 y, tras una educación adecuada y una toma de decisiones compartida sobre los objetivos del tratamiento con los pacientes y sus cuidadores, los médicos deberían considerar iniciar teplizumab para retrasar la progresión a la T1D en etapa 3 o derivar a los pacientes elegibles a atención especializada según los criterios que se muestran a continuación.¹ Además, en octubre de 2024 se introdujeron códigos de diagnóstico específicos para la T1D en etapas tempranas que pueden facilitar la selección de pacientes.
El tratamiento con teplizumab requiere una cuidadosa selección de pacientes y una implementación sistemática en centros de infusión especializados con personal capacitado.¹³
El medicamento está indicado para pacientes de 8 años en adelante con T1D en etapa 2. Antes de iniciar el tratamiento, los pacientes deben haber completado todas las vacunas y someterse a un cribado para detectar infecciones activas, incluyendo el virus de Epstein-Barr (EBV), citomegalovirus (CMV), hepatitis, virus de inmunodeficiencia humana (VIH) y tuberculosis (TB). Los parámetros de laboratorio requeridos incluyen hemoglobina, plaquetas, linfocitos, neutrófilos y función hepática adecuados.¹³
No hay datos sobre el uso de teplizumab durante el embarazo; por lo tanto, no se recomienda su uso más de 30 días antes de un embarazo planificado o durante el embarazo. Las personas en edad reproductiva también deben tener una prueba de embarazo negativa antes de la administración.¹³
El tratamiento consiste en 14 infusiones intravenosas (IV) diarias consecutivas (ya sea a través de acceso venoso periférico o central) con un esquema de dosis escalonadas, comenzando con 65 μg/m² el Día 1 y aumentando a una dosis de mantenimiento de 1,030 μg/m² el Día 5. El protocolo aumenta la dosis durante los primeros 5 días porque el síndrome de liberación de citocinas (CRS) es más común al inicio; sin embargo, puede prevenirse en gran medida con premedicación con un antipirético y un antihistamínico administrados al menos 30 minutos antes de la infusión (dosis máxima/edad).
Cada infusión dura 30 minutos con un período de observación de 1 hora. La sesión completa debería durar aproximadamente 2 horas, lo que permite la premedicación. El paciente puede repetir las premedicaciones cada 8 horas según sea necesario, así como el uso de ibuprofeno/paracetamol. Se puede administrar un curso corto de glucocorticoides para mitigar signos y síntomas de reacciones adversas graves y CRS de moderado a severo.¹³
Se deben monitorear los signos vitales y síntomas durante el tratamiento, con especial énfasis en CRS, linfopenia (que suele alcanzar su punto más bajo entre los días 4 y 5), alteraciones de la función hepática y reacciones de hipersensibilidad. La fiebre es el signo principal de CRS. Los criterios específicos para suspender o interrumpir el tratamiento incluyen CRS que dure más de 2 días, linfopenia o neutropenia grave persistente, transaminitis significativa (>5 veces los niveles normales), infección activa o reacciones de hipersensibilidad graves.¹³
El manejo posterior al tratamiento implica el monitoreo de la progresión a T1D en etapa 3 cada 6 meses, generalmente mediante una prueba de tolerancia oral a la glucosa (OGTT) o monitoreo continuo de glucosa.¹³ Un resumen de estas recomendaciones se muestra en la tabla a continuación, que forma parte de la guía de la Sociedad de Endocrinología Pediátrica (PES) de 2024 sobre el tratamiento con teplizumab.¹³
Teplizumab también se está investigando en el ensayo de fase 4 PETITE-T1D en pacientes menores de 8 años con T1D en etapa 2 (NCT05757713) y fue analizado en una extensión de fase 2 (NCT04270942) del ensayo AT-Risk (TN-10).
Otras Terapias Emergentes Modificadoras de la Enfermedad para la T1D
Varios otros agentes en investigación están en desarrollo. Hasta la fecha, la mayoría se han probado en casos de T1D de reciente aparición, algunos con resultados mixtos; estudios adicionales están en curso. Estas investigaciones incluyen enfoques adicionales para modular o eliminar células T efectoras, reducir células B y la presentación de antígenos, así como agentes antiinflamatorios y protectores de células beta. Algunos de los principales agentes en investigación se describen a continuación.
Rituximab. La infusión de rituximab en las semanas 0, 1, 2 y 3 después del diagnóstico de T1D retrasó el deterioro de la función de las células beta a los 12 y 24 meses, redujo los niveles de HbA1C durante 12 meses y disminuyó la necesidad de insulina. Sin embargo, después de 30 meses no se observó diferencia con rituximab. Los eventos adversos primarios ocurrieron con la infusión, sin aumento en la tasa de neutropenia o infección.⁶ Actualmente se está estudiando en combinación con abatacept en el ensayo T1D RELAY.¹⁴
Imatinib. Este inhibidor de la tirosina quinasa, aprobado para la leucemia crónica, fue evaluado en un ensayo de fase 1 con 67 adultos con T1D de reciente inicio. Los resultados sugirieron algún beneficio en la función de las células beta hasta los 12 meses, que desapareció a los 24 meses. Los eventos adversos más comunes fueron infecciones e infestaciones, así como efectos gastrointestinales.⁷
Abatacept. Este CTLA4-Ig está aprobado para la artritis psoriásica y otras enfermedades autoinmunes. Un estudio con 112 participantes (de 6 a 36 años) con T1D de reciente aparición demostró la preservación de células beta en el grupo de intervención a los 2 años, con un retraso estimado de 9.6 meses en la disminución de la función de las células beta. No se observó un aumento en infecciones o neutropenia.⁸
Verapamilo. Este medicamento antihipertensivo regula negativamente la proteína TXNIP, cuya sobreexpresión induce la apoptosis de las células beta. Un ensayo clínico aleatorizado y doble ciego con 88 niños y adolescentes de 7 a 17 años con T1D de reciente diagnóstico mostró una mayor preservación de células beta a 1 año en el grupo de verapamilo en comparación con el placebo.¹⁰
Golimumab. Este anticuerpo monoclonal humano específico para el factor de necrosis tumoral alfa está aprobado para la artritis reumatoide y la colitis ulcerosa. Un estudio de fase 2 encontró niveles más altos de péptido C y menor uso de insulina en niños y adultos jóvenes con T1D que recibieron golimumab versus placebo.¹¹
Globulina Antitimocítica (ATG). Este medicamento inmunosupresor depleciona las células T. Un ensayo clínico en 89 personas con T1D aleatorizadas a ATG solo, ATG con GCSF o placebo demostró una preservación significativa de células beta con ATG solo en comparación con el placebo.¹²
Ustekinumab. Este antagonista de la interleucina (IL) se dirige a IL-12 e IL-23, implicadas en la patogénesis de la T1D. Un estudio de fase 2 en 72 adolescentes con T1D de reciente aparición mostró que los niveles de péptido C eran un 49% más altos en los pacientes que recibieron ustekinumab en comparación con placebo a los 12 meses.¹⁶
Referencias
- Información de prescripción de Teplizumab (Tzield®) 2023. Provention Bio. https://products.sanofi.us/tzield/tzield.pdf.
- Herold KC, Bundy BN, Long SA, et al. Un anticuerpo anti-CD3, teplizumab, en familiares con riesgo de diabetes tipo 1. N Engl J Med. 2019;381:603-613.
- Sims EK, Bundy BN, Stier K, et al. Teplizumab mejora y estabiliza la función de las células beta en individuos con alto riesgo y positivos para anticuerpos. Sci Transl Med. 2021;13:eabc8980.
- Ramos EL, Dayan CM, Chatenoud L, et al. Teplizumab y la función de las células beta en la diabetes tipo 1 recientemente diagnosticada. N Engl J Med. 2023;389:2151-2161.
- Aronson R, Gottlieb PA, Christiansen JS, et al. Estudio DEFEND-1 de otelixizumab en dosis baja, un anticuerpo monoclonal anti-CD3: resultados del estudio fase III aleatorizado en diabetes tipo 1 de reciente aparición. Diabetes Care. 2014;37:2746-2754.
- Pescovitz MD, Greenbaum CJ, Krause-Steinrauf H, et al. Rituximab, la depleción de linfocitos B y la preservación de la función de las células beta. N Engl J Med. 2009;361:2143-2152.
- Gitelman SE, Bundy BN, Ferrannini E, et al. Terapia con imatinib en pacientes con diabetes tipo 1 de reciente aparición: un ensayo fase 2 multicéntrico, aleatorizado, doble ciego y controlado con placebo. Lancet Diabetes Endocrinol. 2021;9:502-514.
- Orban T, Bundy B, Becker DJ, et al. Modulación de la coestimulación con abatacept en pacientes con diabetes tipo 1 de reciente diagnóstico: un ensayo aleatorizado, doble ciego y controlado con placebo. Lancet. 2011;378:412-419.
- Min T, Bain SC. Medicamentos emergentes para el tratamiento de la diabetes mellitus tipo 1: una revisión de los ensayos clínicos de fase 2. Expert Opin Emerg Drugs. 2023;28:1-15.
- Forlenza GP, McVean J, Beck RW, et al. Efecto del verapamilo en la función de las células beta pancreáticas en la diabetes tipo 1 pediátrica recientemente diagnosticada: un ensayo clínico aleatorizado. JAMA. 2023;329:990-999.
- Quattrin T, Haller MJ, Steck AK, et al. Golimumab y la función de las células beta en jóvenes con diabetes tipo 1 de reciente aparición. N Engl J Med. 2020;383:2007-2017.
- Haller MJ, Schatz DA, Skyler JS, et al. La globulina antitimocítica (ATG) en dosis baja preserva la función de las células beta y mejora la HbA1c en la diabetes tipo 1 de reciente aparición. Diabetes Care. 2018;41:1917-1925.
- Mehta S, Ryabets-Lienhard A, Patel N, et al. Declaración de la Sociedad de Endocrinología Pediátrica sobre consideraciones para el uso de teplizumab (Tzield™) en la práctica clínica. Horm Res Paediatr. 2024. https://doi.org/10.1159/000538775.
- Type 1 Diabetes TrialNet. Estudio Rituximab-pvvr/Abatacept en diabetes tipo 1 de reciente diagnóstico (T1D RELAY). https://www.trialnet.org/our-research/newly-diagnosed-t1d/t1d-relay.
- Un estudio para evaluar la terapia con SIMPONI (Golimumab) en niños, adolescentes y adultos jóvenes con diabetes tipo 1 presintomática. https://clinicaltrials.gov/study/NCT03298542#study-record-dates.
- Tatovic D, Marwaha A, Taylor P, et al. Ustekinumab para la diabetes tipo 1 en adolescentes: un ensayo fase 2 multicéntrico, doble ciego y aleatorizado. Nat Med. 2024;30:2657-2666.
- Ensayo clínico fase II/III de Ustekinumab para el tratamiento de la diabetes tipo 1 (UST1D2). https://clinicaltrials.gov/study/NCT03941132?cond=type%201%20diabetes&intr=Ustekinumab&rank=2